聂舟教授团队在细胞人工机械力受体方向取得重要进展
通讯员: 发布时间:2024-03-19 浏览量:次
近日,湖南大学化学化工学院聂舟教授团队取得最新研究进展,开发了一种创新的DNA功能化人工机械力受体(AMR),为机械生物学和生物医学应用开辟了新的可能性。
机械力信号在细胞通讯中扮演着至关重要的角色,它影响细胞的稳态维持、发育进程和病理变化。2021年诺贝尔生理医学奖的获奖成果之一——机械力受体Piezo的研究,凸显了细胞机械响应在生命科学中的关键作用。细胞通过天然机械力受体(如整合素、钙粘蛋白、T细胞受体和Notch受体)感知并响应外部力信号,从而启动一系列信号转导过程,调控细胞特定行为。
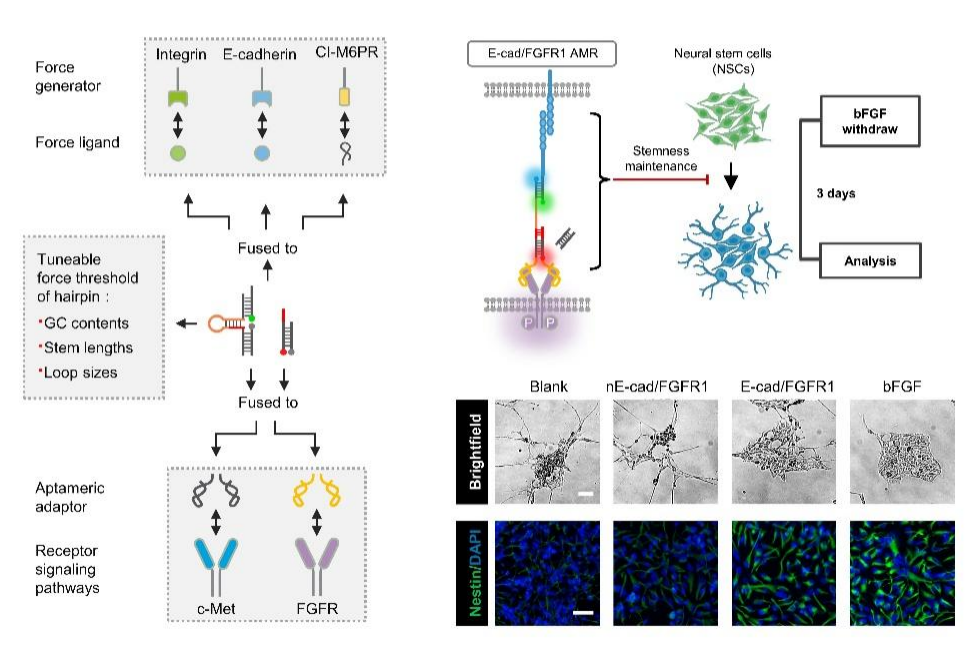
聂舟教授团队开发了一种从头设计的人工机械力受体(AMR),它是一种模块化的DNA-蛋白质嵌合平台,包含通用的机械感知和传递DNA(GMD)纳米器件。AMR能够将原本不具备机械力感应功能的细胞表面受体(如受体酪氨酸激酶,RTKs)重新编程,使其对特定力刺激产生响应。与传统的基因工程改造方法相比,AMR通过化学合成的DNA纳米器件,以一种无需基因改造的非遗传方式对天然细胞表面受体进行调控,展现了很高的适用性和独特优势。
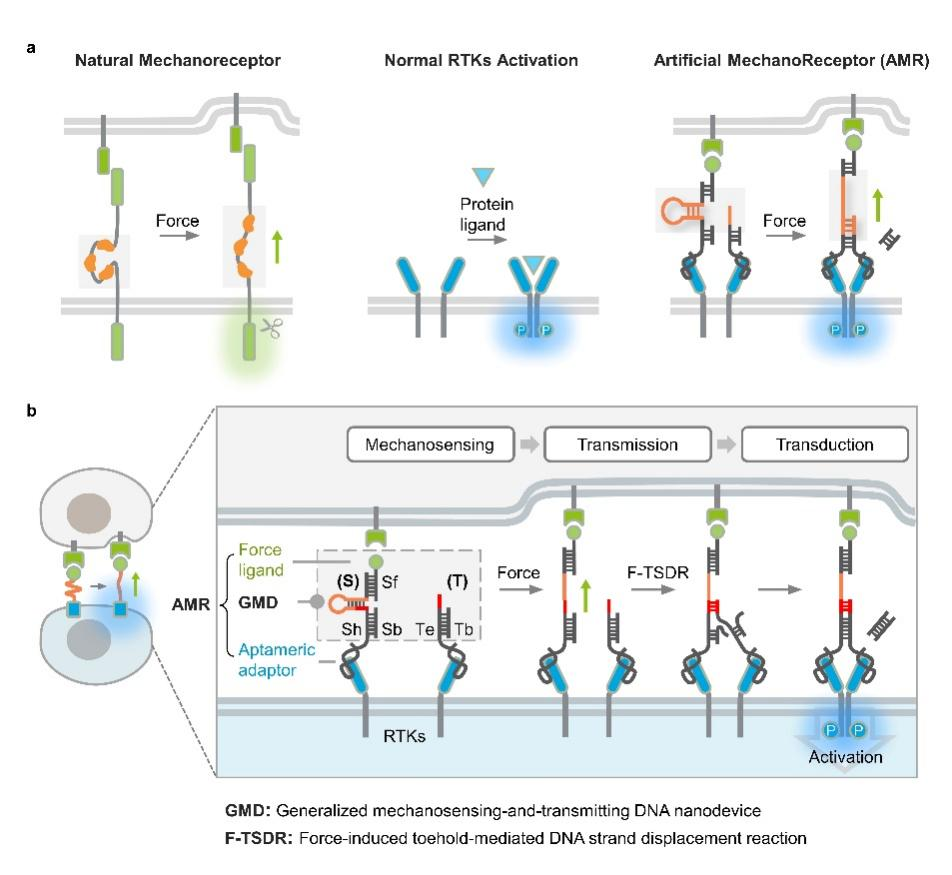
研究团队利用原子力显微镜、共聚焦激光扫描显微镜和dSTORM超分辨成像技术,展示了AMR在细胞膜上的力响应和信号激活性能。该研究发现通过对DNA序列进行简单编程,可以精确调控AMR的力响应阈值,实现在生理条件下皮牛(pN)范围内的精确控制。此外,AMR展现出优秀的通用性,能够灵敏地感知多种细胞产生的力,并调节不同的非机械响应性细胞表面受体。
AMR的设计不仅在细胞力学信号系统重编程方面展现出巨大潜力,还在神经干细胞(NSCs)的干性维持中证明了其生物学功能。通过AMR介导的FGFR1信号通路重编程,在无需外源生长因子的情况下,仅通过细胞间的粘附力就可以维持NSCs的干细胞特性,为优化NSCs的体外培养及其临床应用提供了新思路。AMR策略为深入探索力学生物学原理以及在再生医学领域开发新型细胞疗法提供了全新的化学工具,具有重要的科学和临床应用价值。
相关研究成果以“DNA-functionalized Artificial Mechanoreceptor for de novo Force-responsive Signaling”为题发表在Nature Chemical Biology杂志上。湖南大学化学化工学院化学生物传感与计量学国家重点实验室聂舟教授为唯一通讯作者,湖南大学为唯一通讯单位。化学化工学院博士研究生杨思慧为文章的第一作者。

该工作得到了中国科学院力学研究所龙勉研究员和吕守芹研究员团队在原子力显微镜测试和成像实验方面的技术支持、中国科学院大连化学物理研究所陆瑶研究员团队在高密度微孔阵列芯片制备方面提供的技术协助、中国科学院长春应用化学研究所王宏达研究员团队在dSTORM成像和数据分析方面提供的技术协助。该工作得到了国家重点研发计划和国家自然科学基金的支持。